سبد خرید شما خالی است.
هر نمونه ماده شامل مجموعهای از شمار بسیار زیادی ذرههای سازنده است که این ذرات دارای انرژی جنبشی و پتانسیل میباشند. شیمیدانها انرژی کل چنین سامانهای را هم ارز با محتوای انرژی یا آنتالپی آن میدانند. بنابراین هر سامانه در دما و فشار ثابت، آنتالپی معینی دارد.
- از آنجا که دادوستد انرژی در واکنشها به طور عمده به شکل گرماست، شیمیدانها تغییر آنتالپی هر واکنش را هم ارز با گرمایی میدانند که در فشار ثابت با محیط پیرامون دادوستد میکند.
- مقدار عددی آنتالپی (تغییرات آنتالپی) یک واکنش، بزرگی آن است و اگر واکنش گرماگیر باشد، علامت آنتالپی مثبت و اگر گرماده باشد، علامت آن منفی است.

نکته: انجام فرایندهای فیزیکی و شیمیایی منجر به تغییر محتوای انرژی مواد میشود، از این رو انجام هریک از آنها با جذب یا از دست دادن گرما همراه است.
آنتالپی پیوند و میانگین آن
طی یک واکنش شیمیایی تغییراتی در ساختار (شیوه اتصال اتمها) و خواص مواد ایجاد میشود. یکی از این تغییرات خواص، محتوای انرژی مواد است.
آنتالپی پیوند یعنی مقدار انرژی که مصرف میشود تا یک مول ماده شیمیایی در حالت گازی به اتمهای سازندهاش تجزیه شود.

فلش کارت بالا، نمونهای از فلشکارتهای جامع شیمی ماست و باعث میشود شیمی کنکور را دیگر فراموش نکنید! برای اطلاعات بیشتر روی فلشکارت شیمی کلیک کنید.
برای آشنایی بیشتر آنتالپی پیوند توصیه میکنم کلیپ زیر، که بخشی از فیلم مفهومی شیمی یازدهم است را تماشا کنید:
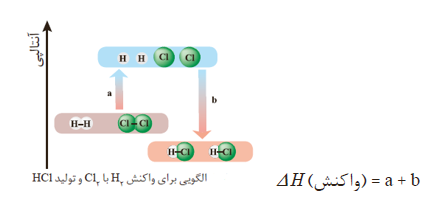
به عنوان مثال، انرژی لازم برای شکستن پیوندهای موجود در یک مول H2 در حالت گازی و تبدیل آن به دو مول H در حالت گازی، ۴۳۶KJ است. در ترموشیمی به این مقدار انرژی، آنتالپی پیوند H-H میگویند.
نکته: در مولکولهایی که اتم مرکزی به چند اتم کناری یکسان با پیوندهای اشتراکی متصل است، از واژه میانگین آنتالپی پیوند استفاده میشود. مثل CH۴
آنتالپی پیوند، راهی برای تعیین ΔH واکنش
شیمیدانها به کار بردن آنتالپی پیوند و میانگین آن را روشی برای تعیین آنتالپی یک واکنش میدانند و این روش را برای واکنشهایی مناسب میدانند که همه مواد شرکت کننده در آن حالت گازی دارند و در واکنشهای گازی با مولکولهای پیچیده اغلب در مقایسه با دادههای تجربی، تفاوتی آشکار وجود دارد.
در یک واکنش شیمیایی تصور میشود که تعدادی از پیوندهای اشتراکی در مولکولهای مواد واکنشدهنده میشکند و تعدادی پیوند جدید تشکیل میشود تا مواد فراورده پدید آیند. در اثر شکسته شدن پیوند میان مواد واکنشدهنده انرژی مصرف شده و در اثر تشکیل پیوندهای جدید انرژی آزاد میشود. جمع جبری این انرژی ها معادل آنتالپی واکنش میباشد.
آنتالپی سوختن، تکیهگاهی برای تأمین انرژی
آنتالپی سوختن، مقدار انرژی آزاد شده به ازای سوختن یک مول از یک نوع ترکیب در اکسیژن خالص و کافی در دمای ۲۵ درجه سانتیگراد و فشار یک اتمسفر است.
نکات:
- کربوهیدراتها، چربیها و پروتئینها افزون بر تأمین مواد اولیه برای سوختوساز یاختهها، منابعی برای تأمین انرژی آنها نیز هستند.
- تنها کربوهیدراتها هستند که در بدن به گلوکز شکسته شده و گلوکز حاصل از آنها در خون حل میشود.
- گلوکز هنگام اکسایش در یاختهها، انرژیای تولید میکند که انرژی مورد نیاز یاختهها را تأمین میکند.
- چربی ارزش سوختی بیشتری از کربوهیدراتها و پروتئینها دارد و انرژی حاصل از اکسایش یک گرم چربی بیشتر از دو ماده غذایی دیگر است.
- میزان انرژی مورد نیاز بدن هر فرد به وزن، سن و میزان فعالیتهای روزانه او بستگی دارد و مقدار اضافی انرژی و مواد دریافتی در بدن به شکل چربی ذخیره میشود.
- بخش عمدهای از گاز شهری را متان تشکیل داده که در حضور اکسیژن کافی میسوزد و آب و کربندیاکسید (هر دو در حالت گازی) و مقدار زیادی انرژی آزاد میکند. (کربندیاکسید و بخار آب از گازهای گلخانه ای هستند)
- سوختهای فسیلی تکیهگاهی برای تأمین انرژی در صنعت، کشاورزی و زندگی روزانه هستند.

در صورتی که برای شیمی سال یازدهم، نیاز به یک آموزش جامع و مفهومی دارید، استفاده از بسته مفهومی شیمی یازدهم را به شما توصیه میکنم. برای اطلاعات بیشتر بر روی تصویر زیر کلیک کنید:

دانلود فایل PDF خلاصهای ازآنتالپی شیمی یازدهم
برای دریافت مطالب کنکوری بیشتر، عضو کانال تلگرام شیمی کنکور و پیج اینستاگرام شیمی ما بشوید و برای تماشای کلیپ های آموزشی به کانال آپارات ما نیز مراجعه کنید.
اگر شما هم راجع به ” آنتالپی شیمی یازدهم ” سوالی دارید، زیر همین پست بنویسید. قول می دهیم تا جای ممکن پاسخ دهیم.











