سبد خرید شما خالی است.
انحلال پذیری، بیشترین مقدار از یک حل شونده بر حسب گرم است که در دمای معین در ۱۰۰ گرم آب (حلال) حل میشود و محلول سیر شده تولید میکند.
فرمول محاسبه انحلال پذیری:

مواد محلول، کم محلول و نامحلول
مواد حل شونده جامد را بر اساس میزان انحلال پذیری در آب و دمای معین به صورت زیر دستهبندی میکنند:
- محلول: انحلال پذیری بیش از یک گرم مانند شکر، سدیم نیترات و سدیم کلرید
- کم محلول: انحلال پذیری بین ۰.۰۱g تا ۱g مانند کلسیم سولفات
- نامحلول: انحلال پذیری کمتر از ۰.۰۱g مانند کلسیم فسفات، باریم سولفات، منیزیم هیدروکسید، نقره کلرید و هگزان (C۶H۱۴)
محلول سیر نشده، سیر شده و فراسیر شده
محلولها بر حسب مقدار حل شونده به سه دسته تقسیم میشوند:
- محلول سیر نشده: محلولی که در دمای معین میتواند مقدار بیشتری حل شونده را در خود حل کند.
- محلول سیر شده: محلولی که در دمای معین نمیتواند مقدار بیشتری حل شونده را در خود حل کند.
- محلول فراسیر شده: محلولی که در دمای معین مقدار بیشتری از محلول سیر شده در خود، حل شونده دارد.
به عنوان مثال اگر میزان انحلالپذیری ماده X در آب در دمای ۲۰g ،۲۵ºC باشد اگر در ۱۰۰g آب، ۱۰g ماده X را حل کنیم، محلول سیر نشده است.
اگر ۲۰g حل کنیم محلول سیر شده خواهد شد و اگر بتوانیم با روشی ۲۵g حل کنیم (۵ گرم بیشتر)، محلول فراسیر شده به دست میآید.
تغییر انحلال پذیری نمکها در آب با تغییر دما
اغلب نمکها با افزایش دما، انحلال پذیریشان افزایش مییابد مانند: NaNO۳ ،KNO۳ ،KCl
انحلال پذیری برخی نمکها با افزایش دما کاهش مییابد مانند: LiSO۴
نمودار زیر نشاندهنده این است که رابطه این انحلال پذیری نمکها با دما گاهی اوقات به صورت خطی نیست مانند: KNO۳ که شیب ثابت ندارد.

معادله انحلال پذیری بر حسب دما
معادله انحلال پذیری – دما برای برخی از مواد به صورت خطی است و در این مورد میتوان ارتباط انحلال پذیری و دما را به کمک معادله خط راست نشان داد. به این معادله، معادله انحلال پذیری میگویند.
![]() شیب خط (m) را میتوان از رابطه زیر بدست آورد:
شیب خط (m) را میتوان از رابطه زیر بدست آورد:
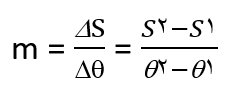 عرض از مبدا (b)، انحلال پذیری ماده را در دمای ۰ºC نشان میدهد.
عرض از مبدا (b)، انحلال پذیری ماده را در دمای ۰ºC نشان میدهد.
عوامل موثر بر انحلالپذیری گازها در آب
انحلال پذیری هر گاز معین به فشار و دما بستگی دارد؛ هرچه فشار بالاتر برود انحلال پذیری گاز نیز به صورت خطی افزایش مییابد. به این پدیده قانون هنری گفته میشود.

نکته: در فشار صفر اتمسفر، انحلال پذیری گازها صفر است.
مقایسه انحلال پذیری گازها در دمای یکسان: NO > O۲ > N۲
شیب نمودار NO از O۲ و N۲ بیشتر است ← فشار تاثیر بیشتری بر انحلال پذیری NO دارد.
هر چقدر دما بالاتر باشد، انحلال پذیری گاز کاهش مییابد.
نکته: در اثر حل شدن نمک در آب، مقدار انحلال پذیری گازها کاهش مییابد.
توجه: مولکول NO قطبی و CO۲ ناقطبی است اما انحلال پذیری CO۲ در آب بیشتر از NO است، دلیل این موضوع جرم مولی بیشتر CO۲ است.
دانلود فایل PDF جمع بندی انحلال پذیری
در انتهای توصیه میکنم به مطالب زیر هم سر بزنید:
برای دریافت مطالب کنکوری بیشتر، عضو کانال تلگرام شیمی کنکور و پیج اینستاگرام شیمی ما بشوید و برای تماشای کلیپ های آموزشی به کانال آپارات ما نیز مراجعه کنید.
اگر شما هم راجع به ”انحلال پذیری شیمی دهم ” سوالی دارید، زیر همین پست بنویسید. قول می دهیم تا جای ممکن پاسخ دهیم.











